
自2019年末新型冠状病毒疫情爆发以来,全世界陷入了大流行病的灾难和恐慌之中,针对病毒的疫苗研究至关重要。然而,新型冠状病毒感染者的症状各异,部分患者轻症甚至无症状,而重症患者却可能危及生命,这说明人体免疫系统针对新冠病毒所产生的免疫反应并非都是保护性的,也有可能是无效的,甚至是有害的。所以,如何正确有效地激发人体保护性免疫反应是成功研制疫苗的关键。疫苗研制有诸多难题,抗原选择需要平衡两大问题:挖掘有效“抗原表位(Epitope)”,避免有害免疫反应发生。
疫情爆发后,中国科学院深圳先进技术研究院合成生物学研究所、香港大学医学院和北京化工大学生命科学院联合攻关,黄建东团队与杜启泓、袁国勇团队合作于2020年07月01日,在Cell Research杂志发表了题为“挖掘来自患者的新型冠状病毒刺突蛋白的抗原表位(Mining of Epitopes on Spike Protein of SARS-CoV-2 from COVID-19 Patients)”的文章,张宝中、胡叶凡、陈琳磊、邱宗祥和童贻刚为共同一作。该工作针对39位新冠肺炎患者的血清进行分析,鉴定出了9个线性免疫显性的抗原表位,其中有4个免疫显性位点均位于受体结合区域(RBD),这为理性设计新冠肺炎疫苗提供了新思路。这项工作获得了深圳市孔雀团队、深圳市科创委基础研究项目和香港特别行政区医疗卫生研究基金2019冠状病毒病研究计划的资助。

寻找“抗原表位” 激发有效的免疫反应
现阶段新冠疫苗的研制主要关注新冠病毒的刺突蛋白(S)。刺突蛋白能够激发人体抵抗新型冠状病毒相关的免疫反应,然而由于我们对于这种新型冠状病毒的了解有限(1),针对刺突蛋白的免疫反应更是知之甚少。要想疫苗能够有效激发保护性免疫反应,就需要鉴定刺突蛋白的什么部位可以激发免疫反应,这些可以激发免疫反应的部位就被称为“抗原表位”。
目前有大量针对新冠病毒中和抗体的研究(2-4),但是真正解析出能被抗体结合的“抗原表位”仍然有限,其中的原因之一是“抗原表位”的三维构象十分复杂,精确解析其结合位点需要获得抗原抗体复合物的精确结构,难以快速鉴定。因此对于仅包含蛋白质一级结构的线性表位的解析判定,对于研究人体的免疫反应有重要意义。目前由于缺乏体内和体外的数据,研究人员大多使用算法对新冠病毒表面蛋白上的“抗原表位”进行预测(5-10),然而算法预测的结果显然不如体内试验结果可靠,刺突蛋白的抗原性质不明,来源新冠肺炎患者的血清学证据格外重要。
为了挖掘更多的“抗原表位”,多个团队都使用了患者的血清进行了分析。新加坡国立大学的Lisa Ng团队针对6位患者的血清进行分析,鉴定出来两个有潜在中和效应的位点,该工作发表在Nature Communications上(11)。但是这些抗原表位都不在刺突蛋白关键的受体结合区域(Receptor Binding Domain, RBD),要了解刺突蛋白的免疫性质需要进行更为全面的分析,尤其是找到受体结合域(RBD)免疫显性位点。
免疫显性效应 疫苗研制中的“双刃剑”
另一个在疫苗设计过程中存在一个不可忽视的难题即免疫显性效应(immunodominance)——虽然人体对外来抗原大多会产生免疫反应,但是抗原所能激起的免疫反应强度不尽相同。免疫显性效应会导致“抗原表位”之间的竞争:免疫显性的位点会“掩盖”亚显性位点的免疫反应,也就是说人体只能激起针对免疫显性位点的免疫反应,而“忽视”亚显性位点。这会影响到疫苗的有效性,即如果无效的抗原表位反而激起更强的免疫反应,则会掩盖疫苗开发所期望的疫苗保护位点(12-14)。
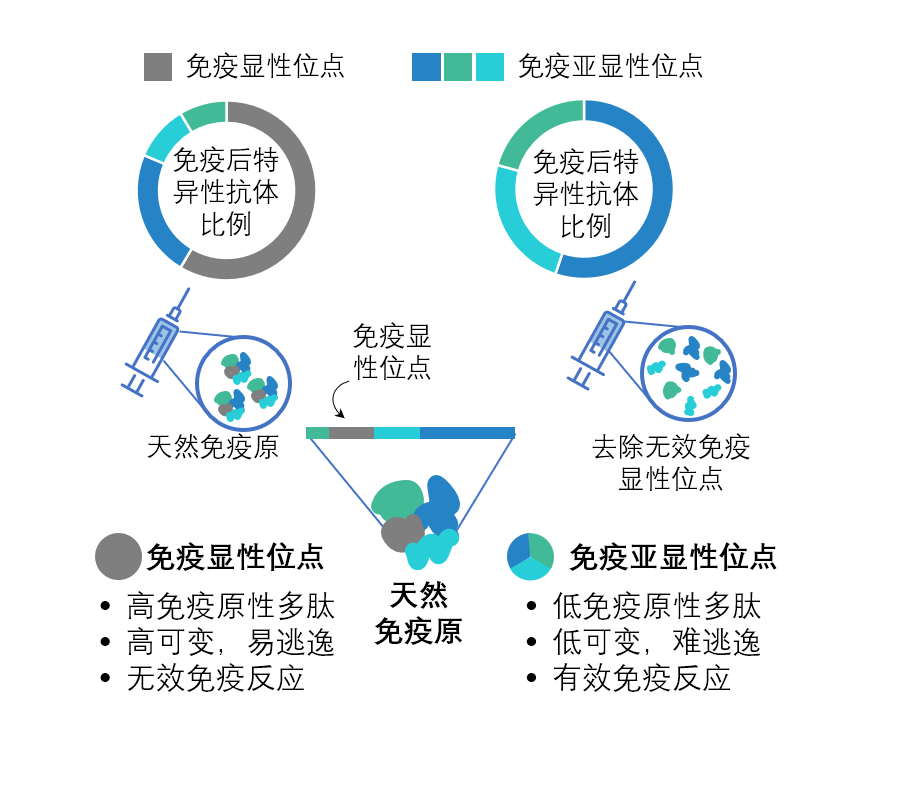
图1:免疫显性现象
免疫显性现象在甲型流感疫苗开发及HIV疫苗开发过程中均有发现。早在2005年对SARS进行研究的时候,研究人员就发现SARS 的刺突蛋白上有5个线性免疫显性位点(immunodominant sites)(15)。直至2010年,研究者才将免疫显性现象和抗体依赖的增强现象(ADE)(有害的或非保护性的免疫反应之一)联系起来,SARS疫苗中的免疫显性位点是一把“双刃剑”,使用免疫显性位点设计出来的疫苗,虽然可以增强对于病毒的中和效应,但是同时也能增强病毒的感染(16)。因此全面筛查刺突蛋白的免疫表位可以为设计安全有效的疫苗提供重要信息。
寻找血清证据 发现有效“抗原表位”
早在2007年,黄建东团队就在国际顶级期刊Angewandte Chemie Int Ed Engl上发表了有关SARS冠状病毒的研究。此次疫情爆发以来,黄建东团队汇集香港大学和深圳先进技术研究院的科研力量,整合粤港澳大湾区和国内多地学术资源就疫苗设计的原理和基础数据进行了快速分析。
团队首先采集了香港地区39位患者的血清,并对其中针对新冠病毒的抗体总量和有效中和抗体的关系进行了分析。针对新冠病毒的抗体总量是反映人体对于新冠病毒的免疫反应强度一个重要指标,而有效的中和抗体水平是人体内保护性免疫反应效果的重要指标。结果发现患者血清抗新冠病毒中和抗体量与刺突蛋白受体结合区域(RBD)的特异性抗体水平有更好的相关性,刺突蛋白的抗原性质与保护性免疫反应水平相关性更强,因此解析刺突蛋白的抗原性质格外重要。
为解决这一问题,张宝中博士和胡叶凡将刺突蛋白分成很多段,对刺突蛋白的膜外区域进行了高覆盖,然后利用39位患者的血清来测试刺突蛋白的哪些区段可以激发人体的免疫反应以及不同患者的免疫偏好性。经过大量的实验,团队发现刺突蛋白有9个线性表位可以结合病人血清中的抗体,这些部位即为免疫显性的线性“抗原表位”,且这些表位在>50%的患者血清中都鉴定到了特异性抗体。将这些线性表位与已经报道的构象抗原表位进行对比,发现二者有大量重合。同时团队还在小鼠中检测了对于新冠病毒的T细胞免疫显性表位,结果与人类的高度类似。
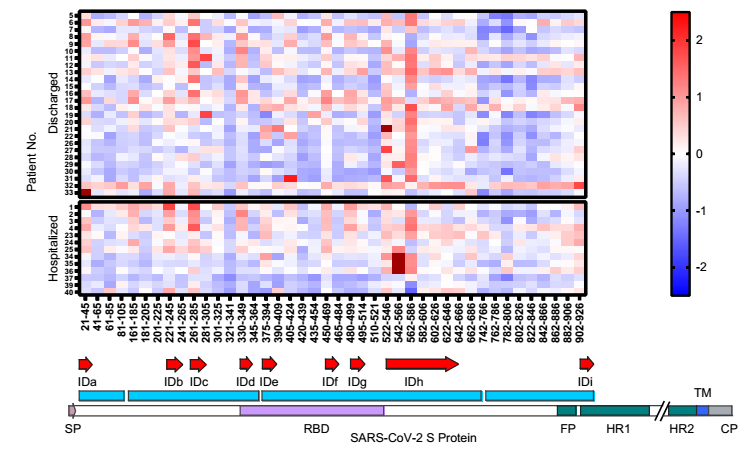
理性设计 筛选保护性“抗原表位”
根据发现的9个免疫显性的线性“抗原表位”,黄建东团队进一步设计了利用免疫显性表位多肽偶联锁孔血蓝蛋白(KLH)进行免疫的方案,对疫苗设计的原理进行测试。锁孔血蓝蛋白(KLH)是一种常用的免疫佐剂,用来递送“抗原表位”。黄建东团队在小鼠模型中发现,免疫后所激起的针对刺突蛋白的抗体量远高于可以有效中和新冠病毒的抗体量,这表明免疫显性表位会诱导产生大量无效的非中和抗体,而这些非中和抗体是否是保护性抗体,是否有害还需要进一步确认。但是针对病毒,人体产生大量非中和抗体很可能是一种“浪费”。疫苗开发过程中“抗原表位”的选择绝非易事,需要平衡好细胞免疫和体液免疫过程中既要有较强的保护性免疫反应,又要确保非保护性免疫反应安全可控。从这一方面来说,构成疫苗的抗原组分不加选择,可能并非最理想的情况。站在长远角度来看,一个理想的新冠疫苗应该基于理性的设计,只诱导产生中和抗体,且不会诱导产生疾病增强的抗体,并尽量减少无用的抗体。
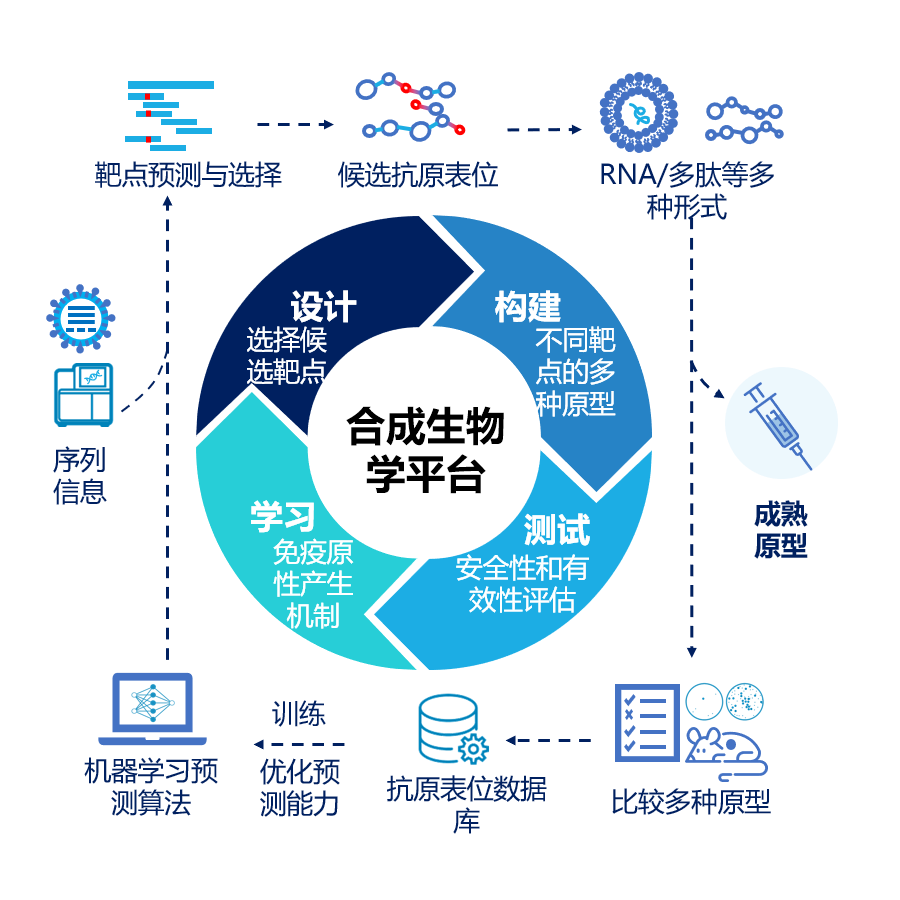
图3:合成生物学疫苗设计的原理图
以此研究为基础,黄建东团队后续计划利用合成生物学的优化系统,提升并优化对于病毒的抗原表位的预测能力,构建基于序列新型的快速设计和学习平台,通过“设计-构建-测试-学习”的闭环,理性选择和优化来源于受体结合区域(RBD)的“抗原表位”,增强这些“抗原表位”的中和效应,进一步在动物模型中进行验证和比较,实现迭代优化,完成成熟原型。
总而言之,这项工作首次系统挖掘了新冠病毒刺突蛋白的免疫显性“抗原表位”,为理性设计新冠疫苗提供了基础。
参考文献
1 Corey, B. L., Mascola, J. R., Fauci, A. S. & Collins, F. S. A strategic approach to COVID-19 vaccine R&D. Science, eabc5312, doi:10.1126/science.abc5312 (2020).
2 Yuan, M. et al. A highly conserved cryptic epitope in the receptor-binding domains of SARS-CoV-2 and SARS-CoV. Science (2020).
3 Pinto, D. et al. Cross-neutralization of SARS-CoV-2 by a human monoclonal SARS-CoV antibody. Nature, doi:10.1038/s41586-020-2349-y (2020).
4 Wu, Y. et al. A noncompeting pair of human neutralizing antibodies block COVID-19 virus binding to its receptor ACE2. Science, eabc2241, doi:10.1126/science.abc2241 (2020).
5 Grifoni, A. et al. A Sequence Homology and Bioinformatic Approach Can Predict Candidate Targets for Immune Responses to SARS-CoV-2. Cell host & microbe (2020).
6 Ahmed, S. F., Quadeer, A. A. & McKay, M. R. Preliminary identification of potential vaccine targets for the COVID-19 coronavirus (SARS-CoV-2) based on SARS-CoV immunological studies. Viruses 12, 254 (2020).
7 Bhattacharya, M. et al. Development of epitope‐based peptide vaccine against novel coronavirus 2019 (SARS‐COV‐2): Immunoinformatics approach. Journal of Medical Virology (2020).
8 Zheng, M. & Song, L. Novel antibody epitopes dominate the antigenicity of spike glycoprotein in SARS-CoV-2 compared to SARS-CoV. Cellular & molecular immunology, 1-3 (2020).
9 Fast, E. & Chen, B. Potential T-cell and B-cell Epitopes of 2019-nCoV. bioRxiv (2020).
10 Lucchese, G. Epitopes for a 2019-nCoV vaccine. Cellular & Molecular Immunology, 1-2 (2020).
11 Poh, C. M. et al. Two linear epitopes on the SARS-CoV-2 spike protein that elicit neutralising antibodies in COVID-19 patients. Nature Communications 11, 2806, doi:10.1038/s41467-020-16638-2 (2020).
12 Dale, G. A., Shartouny, J. R. & Jacob, J. Quantifying the shifting landscape of B cell immunodominance. Nature immunology 18, 367-368 (2017).
13 Angeletti, D. et al. Defining B cell immunodominance to viruses. Nature immunology 18, 456 (2017).
14 Cirelli, K. M. et al. Slow delivery immunization enhances HIV neutralizing antibody and germinal center responses via modulation of immunodominance. Cell 177, 1153-1171. e1128 (2019).
15 He, Y. et al. Identification of immunodominant sites on the spike protein of severe acute respiratory syndrome (SARS) coronavirus: implication for developing SARS diagnostics and vaccines. The Journal of Immunology 173, 4050-4057, doi:10.4049/jimmunol.173.6.4050 (2004).
16 Wang, Q. et al. Immunodominant SARS Coronavirus Epitopes in Humans Elicited both Enhancing and Neutralizing Effects on Infection in Non-human Primates. ACS Infectious Diseases 2, 361-376, doi:10.1021/acsinfecdis.6b00006 (2016).
-------
文字/战略办
编辑/战略办